ATRX ADD结构域关联一种非典型组蛋白甲基化识别机制到人类智力发育迟滞综合征
ATR-X (alpha-thalassemia/mental retardation, X-linked) 综合征是一种人类先天性疾病,其临床表现为α-地中海贫血及智力发育迟滞等。临床遗传学研究发现,患有该综合征的病人大约有50%的错义突变都发生在ATRX基因的ADD(ATRX-DNMT3-DNMT3L)结构域上,而该结构域的具体功能却一直不是很清楚。与哈佛大学医学院施扬教授合作,清华大学结构生物学中心李海涛课题组对ADD结构域进行了深入的结构与功能研究,证明了ATRX ADD(ADDATRX)结构域是一种新型组蛋白赖氨酸甲基化结合模块,可以同时感知组蛋白H3赖氨酸4(H3K4)位和组蛋白H3赖氨酸9 (H3K9)位的甲基化程度。相关成果发表在2011年6月份的《自然结构与分子生物学》杂志上。
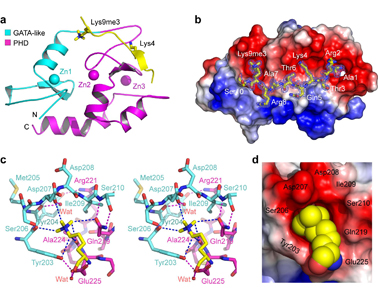
图1 ADDATRX识别组蛋白H3赖氨酸9位三甲基化结构图
在北京同步辐射装置3W1A-生物大分子实验站,李海涛课题组在0.93埃原子分辨率水平获得了ADDATRX 结构域与组蛋白H3K9me3多肽的复合物结构,该研究揭示出如下新型组蛋白甲基化识别机制:
1)ADDATRX通过一个非典型极性口袋,主要以“碳-氧”氢键形式实现对9位赖氨酸三甲基化识别,这与目前已知的赖氨酸三甲基化“芳香笼”读体识别机制截然不同;
2)H3K9me3极性口袋位于构成ADD的两个亚结构域GATA-like锌指与PHD锌指的界面,这种“复合型口袋”有别于其它主要由单个(亚)结构域形成底物口袋的组成方式;
3)ADDATRX对H3K9me3的高效识别不仅依赖于9位赖氨酸三甲基化,而且依赖于4位赖氨酸非甲基化和一个自由组蛋白H3 氨基末端,呈现一种高度协同的组合型识别机制。
ATRX是人类“ATR-X综合征”的关键病因蛋白,该研究工作证实 ATRX蛋白ADD 结构域具有重要的H3K9me3“读体”功能,是ATRX在染色体着丝粒旁区或端粒等异染色质区进行定位并行使染色质重塑功能所不可或缺的,从而在分子水平阐明了ATRX 突变是引发“ATR-X综合征”的致病机理之一。同时,这一工作为人类“ATR-X综合征”的介入性治疗提供了新的途径。
在这项研究工作中,同步辐射光源对该蛋白—多肽复合物的结构解析起到了至关重要的作用。依靠这种极细和高强度的同步辐射光束,才使得这种非典型的组蛋白甲基化识别机制得以清晰地呈现在人们面前。
发表文章:
Shigeki Iwase, Bin Xiang, Sharmistha Ghosh, Ting Ren, Peter W Lewis, Jesse C Cochrane, C David Allis, David J Picketts, Dinshaw J Patel*, Haitao Li* & Yang Shi*, ATRX ADD domain links an atypical histone methylation recognition mechanism to human mental-retardation syndrome. Nature Structural & Molecular Biology, 2011,18,769-776.
