酵母H/ACA RNA引导的假尿嘧啶合成酶的组装和结构
H/ACA RNA-蛋白质复合物(Box H/ACA ribonucleoprotein particles, RNPs)是一类从古细菌到真核生物高度保守的分子,它的主要功能是催化核糖体RNA上特定位点的尿嘧啶转化为假尿嘧啶,同时参与真核生物核糖体的装配和脊椎动物端粒的合成。尽管对来源于古细菌的H/ACA复合物的结构已经有深入的研究,但对于真核生物复合物的结构仍了解甚少。北京生命科学研究所叶克穷博士实验室利用生化和蛋白晶体学分析了酵母H/ACA复合物的结构,发现了许多真核生物复合物特有的结构特征。相关的研究结果于2011年11月15日发表在《Genes & Development》杂志上。
真核生物H/ACA复合物的蛋白质组分难以表达和纯化,这是阻碍相关结构与功能研究的重要原因。叶克穷实验室利用共表达、共纯化的策略得到了性质良好的重组蛋白质,并与体外转录的RNA组装成为适于生化和结构分析的样品。利用这个重组体系,他们发现,和古细菌复合物不同,真核生物复合物H/ACA RNA发夹的上端结构对底物结合和催化不是必需的。真核生物H/ACA RNA具有保守的“双发夹”结构,但是他们发现任何一个“单发夹”结构都能与H/ACA蛋白质组分装配成为具有修饰活性的独立的结构单元。
该研究组还获得了由三个酵母蛋白质(Cbf5, Nop10, Gar1)形成的H/ACA亚复合物的晶体,利用北京同步辐射装置3W1A-生物大分子实验站,在线站相关工作人员的帮助下收集到了高质量的1.9 Å衍射数据。利用分子置换的方法解析了该复合物的三维空间结构,该结构揭示了在真核生物H/ACA复合物中保守的多个特殊结构(图1)。他们发现酵母Gar1核心结构域的C端具有真核生物特有的延伸结构,它能与Cbf5的突环结构形成疏水相互作用(图2)。进一步的生化实验显示这个Gar1延伸结构能调控底物的加载与释放,帮助Gar1在H/ACA RNP成熟过程中替换结合在相同位点的组装因子Naf1。
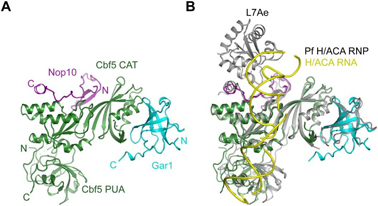
图1酵母H/ACA Cbf5-Nop10-Gar1复合物的晶体结构,以及和古细菌H/ACA RNP的结构比对。
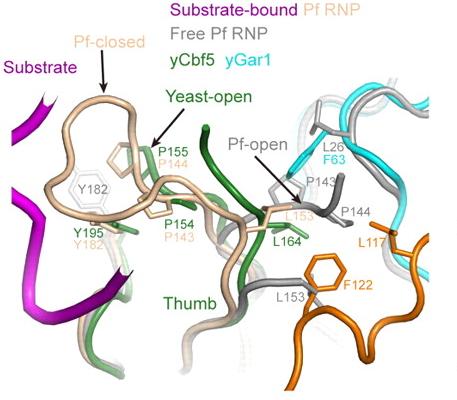
图2真核生物Gar1所特有的C端延伸(用桔黄色表示)和Cbf5突环结构(用绿色表示)形成疏水相互作用,调控底物结合和释放。
此外,人类的Cbf5蛋白质发生突变后会引起一类罕见的先天性角化不良遗传病(dyskeratosis congenita)。真核生物Cbf5特有的N端延伸区域是疾病突变的高发区。酵母Cbf5的结构揭示了该N端延伸在PUA结构域上形成了额外的结构层,为研究突变对疾病的影响提供了更准确的结构模型(图3)。
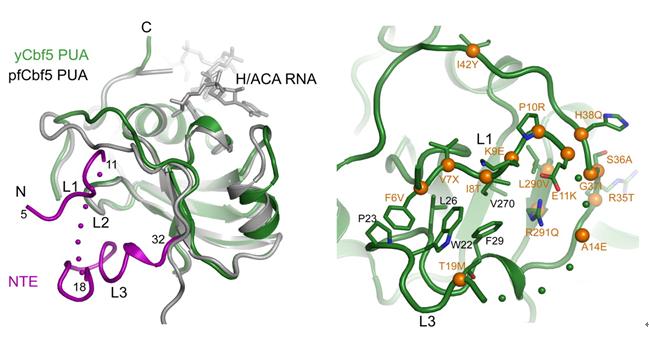
图3酵母Cbf5具有的N端延伸结构在PUA结构域上形成一个额外的结构层(洋红色)。在该处发现多个引起先天性角化不良的突变(桔黄色圆球)。
该工作利用生化实验和在北京同步辐射装置上进行的晶体分析揭示了真核生物H/ACA RNP新的结构特点。未来的工作是解析酵母H/ACA RNP在不同功能态下的晶体结构,进一步揭示H/ACA RNP在进化过程中发生的结构变化。
发表文章:
Shuang Li, Jingqi Duan, Dandan Li, Bing Yang, Mengqiu Dong, and Keqiong Ye*.Reconstitution and structural analysis of the yeast box H/ACA RNA-guided pseudouridine synthase. Genes & Development, 2011, 25, 2409-2421.
