末端电荷调控多肽分子的动态手性自组装
手性普遍存在于自然界和生命体系中,在光学、手性识别、手性催化以及医药等领域具有重要应用。手性纳米结构由于具有独特的分子识别特性、生理活性、光学活性,近年来受到研究人员的广泛关注。手性纳米结构可由生物相关性分子,如:DNA、蛋白质、多肽、π-共轭分子和两亲性脂质等,通过超分子自组装形成。但是目前有关手性放大和手性调控的机理尚不清楚。为了解决这一问题,天津大学酶工程与技术课题组对多肽手性自组装进行了深入研究,实现了对多肽纳米结构超分子手性的动态调控与反转,相关研究成果发表于2017年6月22日发表在期刊《Small》。
该课题组研究发现,通过调节三肽的末端电荷,能够成功制备出左手螺旋、右手螺旋和纳米平带。对组装体系进行微小的pH和温度调节,就可以改变三肽的末端电荷,从而改变静电相互作用,进而控制自组装β-折叠片扭转的方向和角度。当2.0≤pH<7.0,三肽能够组装形成右手螺旋纳米结构;当7.0≤pH<11.5,低温环境下,三肽组装形成平带结构;高温环境下,组装形成外消旋结构;当11.5<pH≤12.3,低温环境下,三肽组装形成左手螺旋纳米结构,而在高温下,组装形成无序聚集体。通过调控pH和温度,纳米螺旋的直径、螺距和手性都可以得到精确控制。此外,组装形成的三肽纳米螺旋的手性能够动态翻转,使手性材料的应用更有价值。

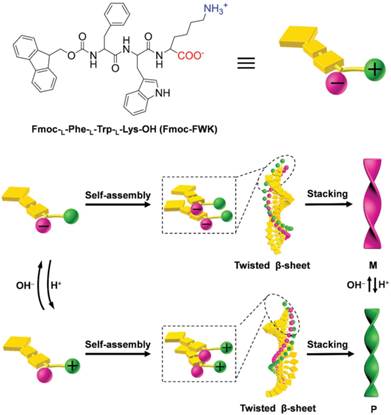
该课题组利用北京同步辐射装置(BSRF)1W2A-小角散射线站的WAXD技术解析了左手螺旋、右手螺旋和纳米平带的二级结构。在左手螺旋、纳米平带和右手螺旋中,衍射峰的位置分别出现在4.76和4.98埃,4.82, 4.67和4.54埃,4.67和4.76埃,表明三肽首先组装形成β-折叠片,进而组装形成不同手性纳米结构,在该过程中,氢键和π-π堆积发挥了重要作用。
这项研究为手性纳米结构的精确可控制备提供了一种可行性方法,并且在手性自组装的机理方面进行了深入研究,对手性纳米结构的理性设计和进一步应用具有指导意义。在这项工作中,同步辐射光源为手性纳米结构的微观结构提供了直接证明。该项工作也被遴选为《Small》的正封面论文。
发表文章:
Yanyan Xie, Yuefei Wang, Wei Qi,* Renliang Huang,* Rongxin Su, and Zhimin He, Reconfgurable Chiral Self-Assembly of Peptides through Control of Terminal Charges, Small, 2017, 13(30): 1700999.
