利用固定沉淀剂的分子印迹聚合物解析了重要蛋白质的晶体结构
2015年3月23日,国际综合学术刊物《自然通讯》(Nature Communications)在线发表中国农业大学陈忠周教授和任雪芹教授的合作研究成果:利用固定沉淀剂的分子印迹聚合物(piMIPs)解析了人类脆性X智力缺陷蛋白质(FMRP)的晶体结构。
柔性是蛋白质的一个固有特性,对于它们的生物学功能至关重要,但是蛋白柔性大的区域容易发生构象变化,使得蛋白质分子构象不均一。因此,在蛋白质晶体学领域,要获得高柔性蛋白质的高质量的结晶仍然是一个挑战。
脆性X综合症是一种发病率仅次于唐氏综合征的遗传性智力低下疾病,其发病率男性为1/4000,女性为1/8000,严重危害人类健康,而脆性X智力缺陷蛋白(FMRP)的表达缺失是其发病主要原因。然而其的结构和功能目前还不清楚。
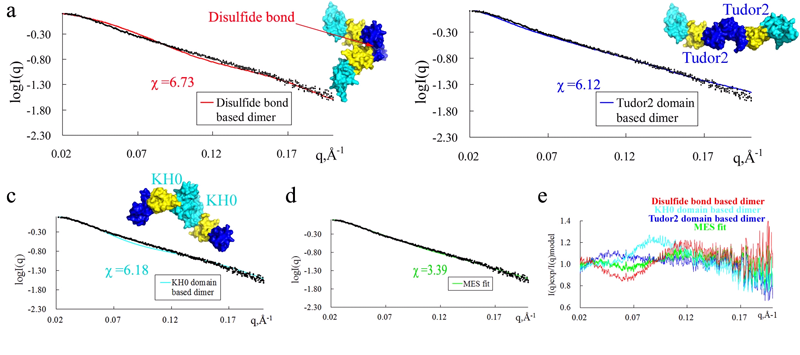
图1 FMRPΔ不同二聚体的理论与实验散射数据对比。
实验发现分子印迹聚合物可能具有促进蛋白质结晶的潜力,于是开发了一种新方法将传统的沉淀剂固定到分子印迹聚合物(piMIPs)上来稳定蛋白质的构象、促进蛋白质结晶。利用这种材料获得了人类脆性X智力缺陷蛋白质(FMRP)的高质量的晶体,揭示了其存在多个新的结构特征:一个新的KH0结构域、分子间二硫键和不同的二聚化形式。此外,还利用这种piMIPs方法成功地促进了5个模型蛋白质晶体的形成,获得的分辨率比目前已报道的分辨率更高,突显了piMIPs在蛋白质结晶领域中的巨大应用潜力。
本课题利用北京同步辐射装置(BSRF)1W2A-小角X射线散射实验站的BioSAXS技术发现FMRP在溶液中以多种构象形式存在,证实了FMRP的高度柔性,解释了FMRP蛋白结构的多样性和复杂性以及在体内功能的复杂性,为人们研究此蛋白的复杂功能提供一个重要的结构基础。
发表文章:
Yufeng Hu, Zhenhang Chen, Yanjun Fu, Qingzhong He, Lun Jiang, Jiangge Zheng, Yina Gao, Pinchao Mei, Zhongzhou Chen & Xueqin Ren, The amino-terminal structure of human fragile X mental retardation protein obtained using precipitant-immobilized imprinted polymers. Nature Communications, 2015, 6, 6634.
