能量耦合转运体中底物识别蛋白的研究
2014年3月,清华大学生命学院杨茂君教授研究组在《细胞研究(Cell Research)》上发表学术论文《Planar substrate binding site dictates the specificity of ECF-type nickel/cobalt transporters》(底物平面结合位点决定了镍/钴能量耦合转运蛋白的底物特异性)。文章首次报道了镍/钴金属离子转运复合体中底物识别蛋白NikM的高分辨晶体结构,并通过生物化学、细胞生物学、生物物理学,量子化学及计算生物学等手段,系统地阐明了此类蛋白质复合物家族在底物识别及转运的分子机制,为理解微生物在维生素B12的合成过程中钴离子的摄取提供了新视点。
从环境中吸收痕量存在的镍/钴离子对微生物的存活至关重要,已知ECF(energy coupling factor,能量耦合因子)转运体是分布最广的镍/钴离子的主动运输转运体。ECF从底物类别上分为两大类,一类是维生素类ECF转运体,其底物识别蛋白可以特异性结合相对应的维生素。另一类是金属离子类ECF转运体,其底物识别蛋白可以特异性识别相对应的过渡金属离子。现已知有多个维生素类ECF底物识别蛋白的结构得以解析,相关识别和转运机制也研究的比较清楚。但是,目前为止还没有过渡金属离子类ECF底物识别蛋白的结构信息,其特异性识别镍/钴金属离子的分子机制也亟待阐明。
清华大学杨茂君课题组利用4W1B的μ-XRF分析手段,对第一个离子类ECF转运体中底物识别蛋白NikM进行了元素分析,并综合生物化学、细胞生物学、生物物理学、量子化学及计算生物学等手段,确定了NikM是通过平面四配位的底物结合位点识别镍/钴离子(图5.1.10-5),进而系统地阐明了此类蛋白质复合物家族在底物识别及转运等过程的分子机制,为理解微生物在维生素B12的合成过程中钴离子的摄取提供了新的视点。
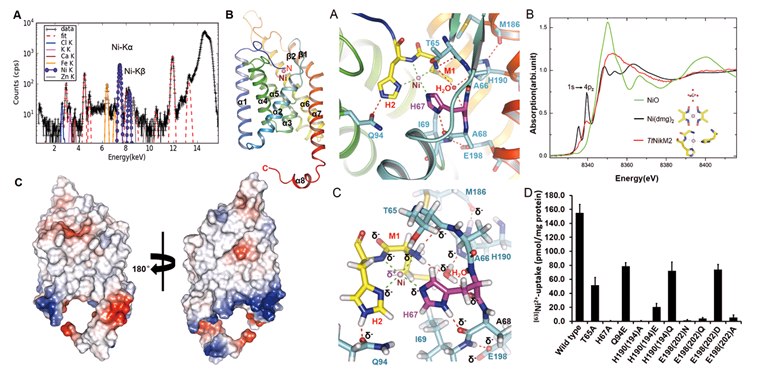
图5 μ-XRF用于NikM底物元素分析
