LSD2蛋白的结构和功能研究
组蛋白的共价修饰是表观遗传的主要调控机制之一,而赖氨酸的甲基化修饰又是其中的一个重要方面,它参与诸如异染色质形成、X染色体失活和基因印记等重要的生物学过程。赖氨酸的甲基化是可逆的修饰过程,它的甲基化和去甲基化过程分别由甲基转移酶和去甲基化酶催化完成。人源LSD2属于FAD依赖型氨氧化酶家族,在转录调控和基因印记方面起着重要作用。LSD2是与癌症相关的潜在的候选基因,它在多种类型癌症中都以很高的几率出现染色体移位、删除或放大的现象。LSD2在几种类型的白血病和乳腺癌中LSD2表达量下降,因此可以把LSD2作为潜在的癌症治疗靶标。然而,这个蛋白的生物化学和功能仍没有被弄清楚。中国农业大学的一个研究组对LSD2蛋白的结构和功能进入了深入的研究,相关的研究成果发表在2013年2月的《Cell Research》上。
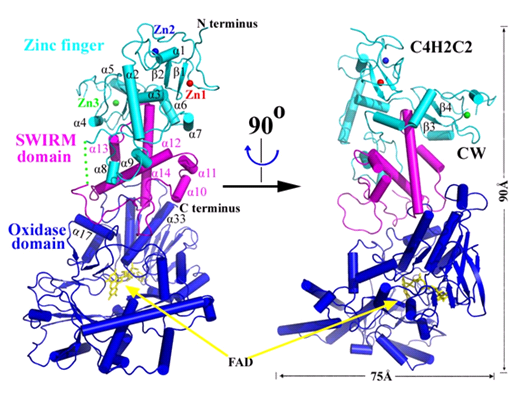
该研究利用北京同步辐射装置(BSRF)解出了的2.13 Å分辨率的 LSD2的复合物晶体结构。LSD2包括三个结构域,分别命名为N端的锌指结构域(Zinc-finger domain)、中间的SWIRM结构域和C端的胺氧化酶结构域(Amine oxidase domain,AOD),这三个结构域紧密堆积在一起形成靴子状结构。胺氧化酶结构域的活性中心空腔足够容纳组蛋白H3尾巴的数个氨基酸残基,但不能辨别H3K4的不同甲基化状态。N端的锌指结构域由一个全新拓扑结构的C4H2C2型锌指结构和一个特殊的CW型锌指结构组成。C4H2C2型锌指结构表面富含正电荷,可能与DNA或其它富含负电荷的蛋白质发生相互作用而有利于LSD2对H3K4me1/2进行去甲基化。CW型锌指结构不同于以往发现的其它CW型锌指结构。事实上,结构分析表明锌指结构域--SWIRM结构域--胺氧化酶结构域之间形成的相互作用网络对于保持LSD2活性构象和去甲基化酶活性是必需的。这些结果揭示了通过在LSD2三个结构域之间接力传递的相互作用来实现锌指结构域远程调控其去甲基化酶活性的新机制,对于阐明LSD2的调控机制及功能,癌症的治疗提供了新的思路。
发表文章:
Qi Zhang, Shankang Qi, Mingchu Xu, Lin Yu, Ye Tao, Zengqin Deng, Wei Wu, Jiwen Li, Zhongzhou Chen* and Jiemin Wong*. Structure-function analysis reveals a novel mechanism for regulation of histone demethylase LSD2/AOF1/KDM1b. Cell Research (2013) 23:225–241.
